BCOR - Cs/B3 TEM-Korrektor für die aberrationsfreie Abbildung im TEM mit großformatigen Bildfeldern

BCOR - Cs/B3 TEM-Korrektor für die aberrationsfreie Abbildung im TEM mit großformatigen Bildfeldern
Nach Korrektur der sphärischen Aberration Cs (Öffnungsfehler C3) ist die außeraxiale Koma der nächste intrinsische Rundlinsenfehler, der sich auflösungsbegrenzend im TEM auswirkt. Dies gilt insbesondere für große Bildfelder, d.h. z.B. bei TEM-Aufnahmen mit großen Detektoren (4kx4k Kameras und größer). Der BCOR wurde entwickelt um sowohl den Öffnungsfehler C3 als auch die außeraxiale Koma B3 zu korrigieren, und somit aberrationsfreie Abbildung bis in die Randbereiche der Bildfelder von großen Kamerasystemen zu ermöglichen. Dank seines optimierten Aufbaus liefert der BCOR die Möglichkeit alle parasitären(+) axialen Aberrationen bis zur einschließlich 4. Ordnung und alle außeraxialen Aberrationen bis zur einschließlich 3. Ordnung zu korrigieren. Das BCOR-Design wurde sorgfältig zur Vermeidung intrinsischer, höherer außeraxialer Restfehler optimiert und erlaubt zudem die vollständige Korrektur des sechszähligen Astigmatismus der 5. Ordnung. Damit ist der BCOR der erste Korrektor der eine vollständig „aplanatische“ Abbildung im TEM ermöglicht. Sowohl im Bereich der Materialwissenschaften als auch in der Life-Science-Anwendung (z.B. bei Single-Particle-Reconstructions) hat sich der BCOR v.a. in Kombination mit sehr großen Kameradetektoren (4kx4k) durch die zuverlässige Korrektur aller dominanten Bildfehler über das gesamte aufgenommene Gesichtsfeld bewährt.
(+) Parasitäre Aberrationen = Aberrationen, die durch Toleranzen und Ungenauigkeiten in der mechanischen Montage des Korrektors entstehen
Merkmale:
- Hexapol-Typ Cs/B3 Korrektor für TEM
- Korrektur der außeraxialen Koma B3, und aller parasitären außeraxialen Bildfehler bis zur einschließlich 3. Ordnung, zur Auflösungssteigerung in den äußeren Bildfeldbereichen.
- Korrektur aller axialen Bildfehler bis zur 5. Ordnung (A1, B2, A2, C3, S3, A3, A4, B4, D4, A5)
- Ermöglicht echte „aplanatische“ Abbildung im TEM
- Informationslimit besser als 70pm bei 300kV
- Kompatibel mit folgenden TEMs: Hitachi HF-3300S, TFS Titan/Krios, weitere auf Anfrage
Technische Daten:
- Maße (HxBxT): 434 x 390 x 279 [mm]
- Mikroskopie-Modus: TEM
- Hochspannungsbereich: 60kV – 300kV
Anwendungsbereich:
Einsatz in der hochauflösenden Transmissionselektronenmikroskopie (TEM), v.a. in Kombination mit sehr großen Kameradetektoren (4kx4k und größer) im Bereich der Materialwissenschaften und für Life-Science-Anwendungen.
Kontakt
Haben Sie Fragen zu diesem Produkt oder zu Anwendbarkeit und Erweiterung für Ihr System, dann kontaktieren Sie uns unter info@ceos-gmbh.de

Illustration des Einfluss außeraxialer Bildfehler: a) unkorrigierter außeraxialer Astigmatismus: der zwei-zählige Astigmatismus variiert über das Bildfeld und begrenzt daher ortsabhängig das Auflösungsvermögen. b) Nach der Korrektur aller linearen außeraxialen Aberrationen bis zur dritten Ordnung mit dem BCOR sind die Abbildungsbedingenen im gesamten Bildfeld von identischer Qualität. Verwendet wurde eine Probe aus amorphen Wolfram. Die Bilder wurden mit einer CCD Kamera (2k x 2k , gNy= 5.36/nm, FoV 191nm x 191nm) an einem Hitachi HF3300 mit kalter Emissionsquelle bei 300kV aufgenommen.
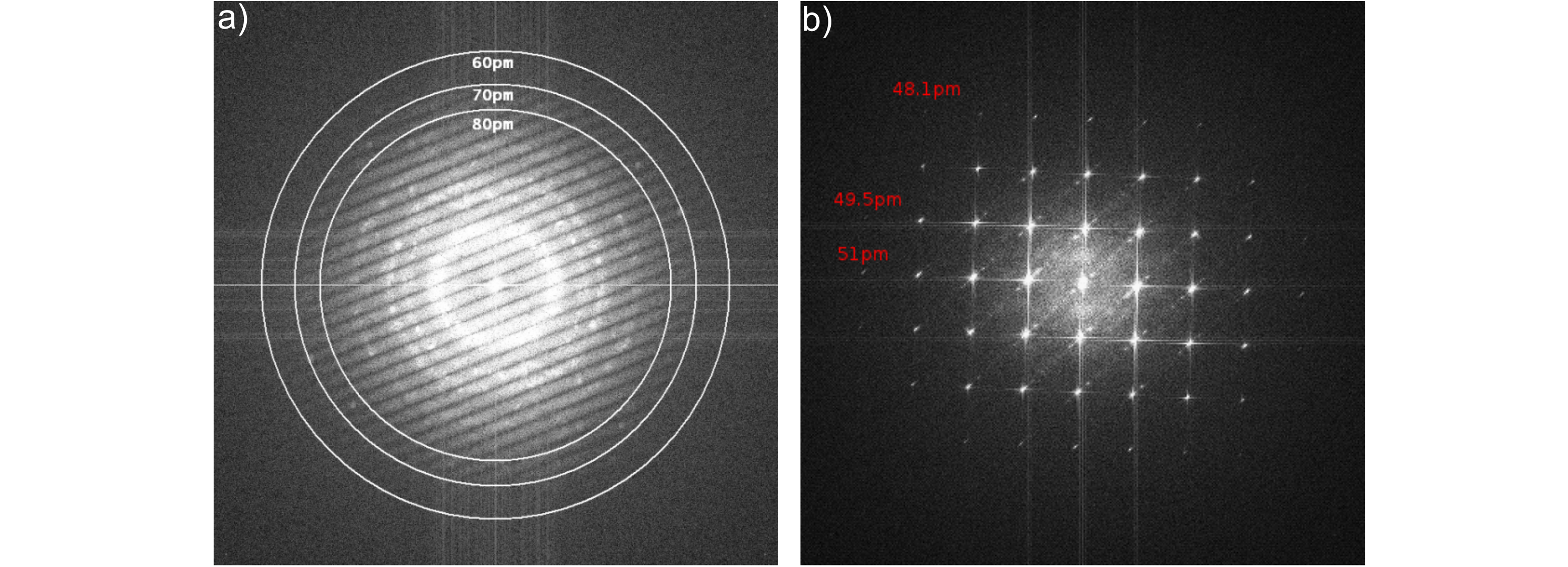
a) Young's Fringes Auflösungstest am Hitachi HF-3300 Elektronenmikroskops mit BCOR bei 300kV mit einer dünne Wolframfolie. Das sub-70pm Informationlimit ist klar zu erkennen. b) Im Diffraktogram einer Aufnahme von orientiertem Gold (Au [100]) sind entsprechend hohe Beugungsordnungen zu beobachten.
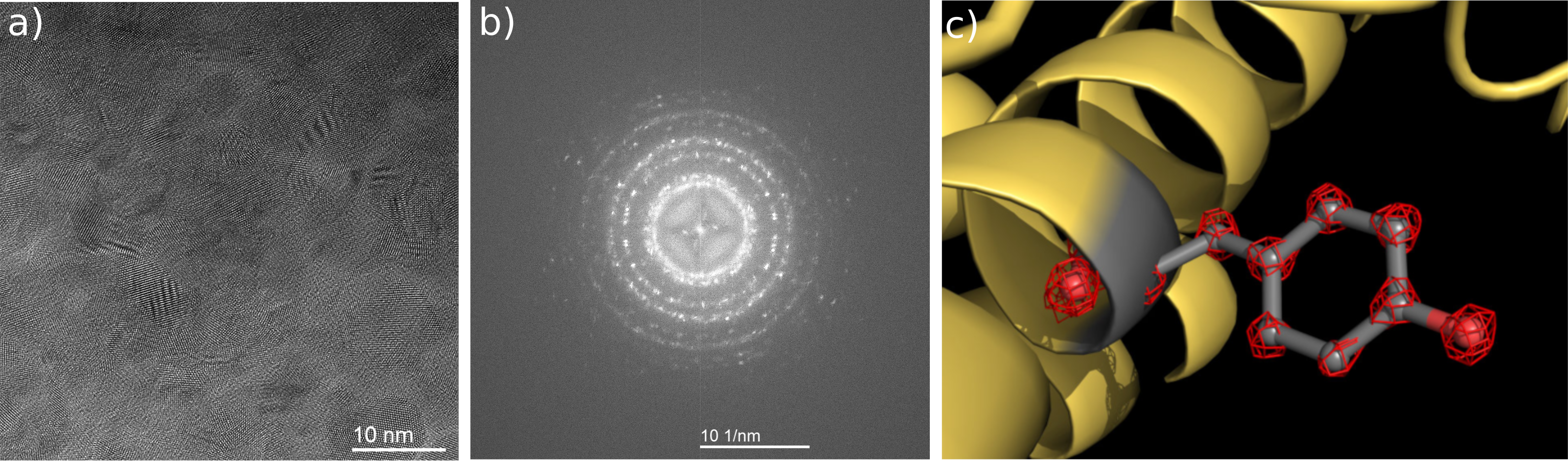
Der BCOR von CEOS verhilft der Kryo-Elektronenmikroskopie zu einem neuen Auflösungsrekord: a) Die Aufnahme und b) das Diffraktogramm von Gold-Partikeln bei 300kV in einem TFS Cryo-TEM mit BCOR entstand mit monochromatisierter Beleuchtung und zeigt die hervorragende Auflösungsqualität des korrigierten Elektronenmikroskops. Ein schneller Detektor erlaubt eine Akkumulation von drift-korrigierten Teilbildern über die Gesamtaufnahmedauer von 20 s hinweg. c) Das Team von Prof. Holger Stark hat mit der Kryo-Elektronenmikroskopie erstmals einzelne Atome in einem Protein sichtbar gemacht. Die Cartoon-Darstellung zeigt einen Teils des Apoferritin-Proteins (gelb), bei dem eine Tyrosin-Seitenkette grau herausgehoben ist. Die Aminosäure Tyrosin besteht aus mehreren Atomen, die in der Struktur einzeln erkennbar sind (rote Gitterstrukturen). Ka Man Yip, Niels Fischer, Elham Paknia, Ashwin Chari, Holger Stark: Atomic-resolution protein structure determination by cryo-EM. Nature, October 21, 2020.

